竞争性抑制剂
| 竞争性抑制剂 |
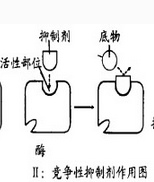 |
竞争性抑制剂是产生竞争性抑制作用的抑制剂。它与被抑制的酶的底物通常有结构上的相似性,能与底物竞相争夺酶分子上的结合位点,从而产生酶活性的可逆的抑制作用。而另一类竞争性抑制剂在化学结构和分子形状上与底物无相似之处,因此并不在活性中心与酶结合,而是在活性中心以外的地方结合。然而一旦结合,酶的构象就发生变化,从而导致活性中心不能再结合底物。同样,若底物先与活性中心结合,就会导致抑制剂结合部位的构象改变,致使抑制剂无法再与酶结合。因此,这一类竞争性抑制剂与底物在和酶结合这一点上也是相互排斥的。
第二种竞争性抑制剂与非竞争性抑制剂的差别在于,非竞争性抑制剂和底物可同时与酶结合形成三元复合物IES,而前者不能。
目录
简介
如果抑制剂浓度恒定,则在低底物浓度([s])时抑制作用最为明显,增大[s],抑制作用随之降低,直到[s]增大至很浓时,抑制作用近于消失,达到未加抑制剂时的最大反应速度(Vmax)水平,其动力学特征是:表观反应常数(Km)增大、Vmax不变。抑制程度只与抑制剂浓度有关。
典型的例子如丙二酸和草酰乙酸对琥珀酸脱氢酶的抑制;磺胺药与对氨基苯甲酸(合成二氢叶酸的原料)抑制细菌二氢叶酸合成酶等。
评价
①底物类似物例如,α-葡糖苷酶抑制剂如阿卡波糖(acarbose)、伏格列波糖(voglibose)和米格列醇(Miglitol)
②过渡态类似物如苯甲酰丙氨醛是胰凝乳蛋白酶的过渡态抑制剂。
③其它化合物有些化合物的平面结构与底物并不相似,但立体构象十分相近,也成为竞争性抑制剂。某些竞争性抑制剂的作用原理是抑制剂与一些酶活性中心的金属离子络合,妨碍了底物的进入,从而起到抑制酶活性的目的。[1]