自由能查看源代码讨论查看历史
| 自由能 |
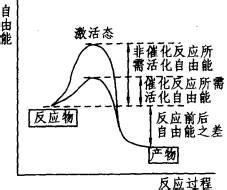 |
自由能是指在某一个热力学过程中,系统减少的内能中可以转化为对外做功的部分,它衡量的是:在一个特定的热力学过程中,系统可对外输出的"有用能量"。可分为亥姆霍兹自由能和吉布斯自由能。
计算方法:
①吉布斯自由能
G = U − TS + pV = H − TS
其中U是系统的内能,T是温度(绝对温度,K),S是熵,p是压强,V是体积,H是焓。
②亥姆霍兹自由能
A = U - TS
其中 U 是系统的内能,T 是温度,S 是熵。
简介
自由能(free energy)在物理化学中,按照亥姆霍兹的定容自由能F与吉布斯的定压自由能G的定义,G=A+PV (P为压力,V为体积)。在生物的反应中,因为△(PV)可以忽略不计,所以两者是相同的。只有这样,A的变化△A=△U-T△S才成为主要讨论的问题(U、T、S分别是该系统的内能、绝对温度、熵)。△A给出了生物反应中释放出来可用于做功的能量上限。其变化量(一般用△G*表示)在生物学上使用时必须注意下列事项:⑴水的活度,可随意设为1.0进行计算:⑵因[H+]=1M并不符合实际情况,一般认为[H+]=10^(-7) M(pH=7),为了区别其符号写成△G0′;⑶例如反应,因各种成分并非标准浓度(1M),把实际浓度代入下式后其值△G′就有问题了;⑷在共轭反应中,要注意各种成分反应的变化量之和;⑸把△G0改为用平衡常数(Keq)表示,往往是很有用的。
评价
历史上,对"自由能"这一术语的使用在不同学科中存在不同。
化学当中,自由能指的是吉布斯自由能,以G表示,同时称亥姆霍兹自由能为"亥姆霍兹函数",以示区别。 物理学当中,自由能指的亥姆霍兹自由能,以A表示,同时称吉布斯自由能为"吉布斯函数",以示区别。[1]