鹼金屬查看源代码讨论查看历史
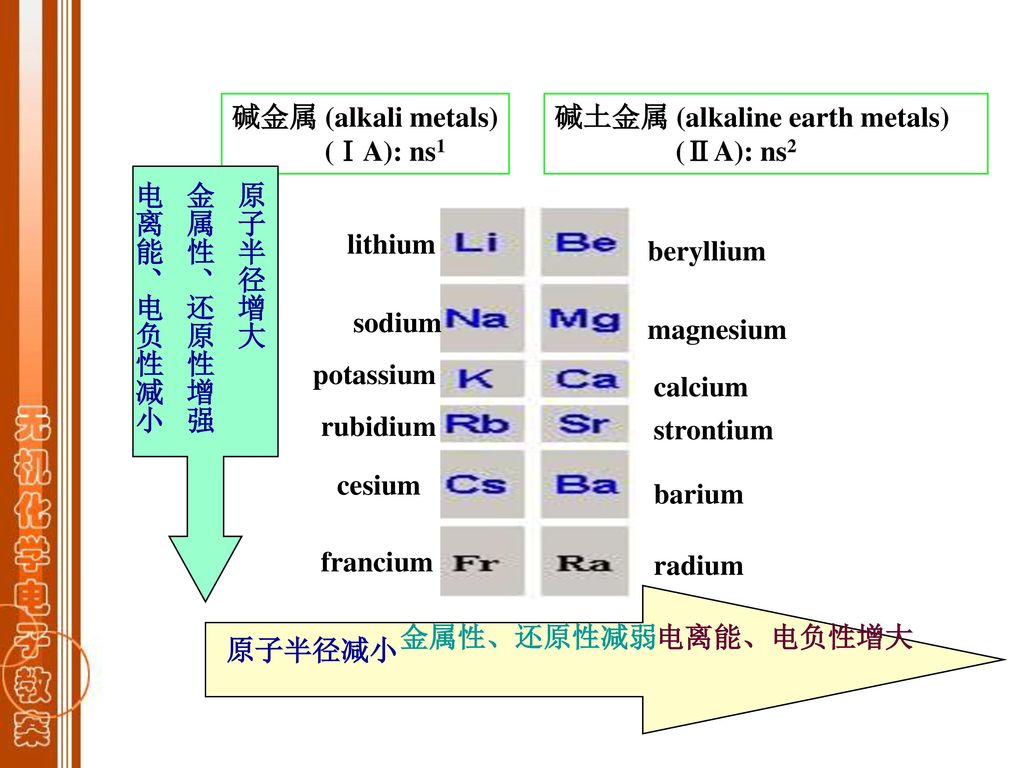 |
碱金属是指在元素周期表[1] 中同属第1族(舊稱ⅠA族)的六个金属元素:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),其中鍅具有強烈的放射性。
碱金属均有一个属于s轨道的最外层电子,,因此这一族属于元素周期表的s区。碱金属的化学性质显示出十分明显的同族元素相似性,是化学元素周期性|periodic trends的例证之一。尽管氢也同属于第1族,但其显现的化学性质和碱金属相差甚远,因此通常不被认为是碱金属。
碱金属有很多相似的性质;都是银白色的金属、密度小、熔点和沸点都比较低、标准状况下有很高的反应活性|reactivity (chemistry)。它们易失去价电子形成带一个单位正电荷的阳离子。它们一般质地较为柔软,可以用刀切开,露出银白色的剖面;由于能和空气中的氧气反应,剖面暴露于空气中将很快失去光泽。由于碱金属化学性质都很活泼,贮存时一般将它们放在礦物油中,或封于稀有气体中保存,以防止其与空气或水发生反应。在自然界中,碱金属元素只有化合态,不能以稳定单质形式存在。碱金属都能和水发生激烈的反应,生成碱性的氢氧化物,其反应能力与剧烈程度随着原子序数的增大而越强。
所有已发现的碱金属均天然存在于自然界中。按照化學元素豐度顺序,自然界化学丰度最高的是钠,其次是钾,接下来是锂、铷、铯,最后是钫。钫的放射性很强,半衰期很短,十分不穩定,因此只能作为天然衰變鏈的产物,在自然界中痕量存在。已有实验试图合成可能的第七个碱金属Uue,但截至目前均以失败告终。此外,由于相对论效应会极大影响包括Uue在内的超重元素的性质,因此Uue可能不是碱金属;即使它真的是碱金属,它的物理性质和化学性质也可能会和其它六个碱金属有较大差异。
碱金属有多种用途。铷或铯的原子钟是游离态碱金属元素最著名的应用实例之一,其中以铯原子钟最为精准。钠化合物较为常见的一种用途是制作钠灯,一种高效光源。人类对食盐(氯化钠)的使用可追溯到古代。钠和钾是生物体中的电解质,具有重要的生物学功能,属于膳食矿物质。尽管其它碱金属并非膳食矿物质,它们同样会对身体产生或有益或有害的影响。
性质
化学性质
碱金属元素的样品,保存在矿物油中以防氧化。从左至右:锂、钠、钾、铷、铯 这一族的核外电子结构(特别是最外层电子)模式特殊,因此它们的化学性质呈规律性变化:
| Z | 元素 | 核外电子构型 | 电子排布 |
|---|---|---|---|
| 3 | 锂 | 2, 1 | [He] 2s1 |
| 11 | 钠 | 2, 8, 1 | [Ne] 3s1 |
| 19 | 钾 | 2, 8, 8, 1 | [Ar] 4s1 |
| 37 | 铷 | 2, 8, 18, 8, 1 | [Kr] 5s1 |
| 55 | 铯 | 2, 8, 18, 18, 8, 1 | [Xe] 6s1 |
| 87 | 钫 | 2, 8, 18, 32, 18, 8, 1 | [Rn] 7s1 |
由于具有强烈的放射性,钫可展现的的化学性质十分有限,因此它的化学性质并未得到深入研究。对碱金属元素的化学性质研究主要针对这一族的前五个元素。
已知的碱金属元素均为活泼金属,至今尚未发现碱金属的天然单质。因此,碱金属通常泡在矿物油或煤油中保存。碱金属和卤素剧烈反应生成卤化物,为白色的离子晶体,除氟化锂外均可溶于水。碱金属和水反应生成强碱性的氢氧化物溶液,因此应当妥善保存。原子量越大(越“重”)的碱金属,反应越为剧烈:比如铯加入水中引发的爆炸比钾更剧烈,就是一个例子。
由于拥有较低的有效核电荷,且只需失去一个电子就能达到稀有气体电子结构,碱金属元素的第一电离能是同周期元素中最低的。与之相对的是,碱金属的第二电离能普遍很高,因为失去一个电子的碱金属离子为稀有气体电子结构,而且电子和原子核的距离下降了。这一能量差异导致碱金属在反应中通常失去一个电子,形成一价正离子。
化学家起初认为碱金属不会形成负离子,但后来的研究发现了一类含负一价碱金属离子的不稳定化合物,称作碱化物。碱化物中的碱金属负离子有充满的s亚层,这使得它更加稳定。“反氢化钠”,H+Na-,是这类化合物中一个引入注目的例子。通常的氢化钠应当是Na+H-,反氢化钠具有与之相反的电荷分布。因此,反氢化钠的能量高,纯净物很不稳定,但它的几种衍生物已被预测为稳定或介稳定的。根据目前已知的信息,除锂之外的碱金属都能形成碱化物。碱化物的化学性质和电子盐(一种以束缚电子为负离子的盐)类似。由于拥有不同寻常的化学计量和低电离电位,碱化物有很高的理论研究价值。
锂离子(Li+)的半径很小(76pm),会极化化合物中的阴离子,使化合物具有一定共价性;因此,锂的化学性质和这一族中的其他元素有一些差异。例如,氟化锂是唯一不溶于水的碱金属卤化物;氢氧化锂是唯一不潮解的碱金属氢氧化物。锂和镁存在对角线规则,锂的某些化学性质和镁相近。比如说,锂可以形成稳定的氮化物,这一性质在镁所在的碱土金属中很普遍,但在碱金属中则显得独特。此外,在各自所在的族中,只有锂和镁可以形成共价有机金属化合物。
根据推测,钫和其它碱金属也会有一些性质差异。钫的原子量很高,它的电子运动较快,会引发更明显的相对论效应,钫具有的7s电子因而会更稳定。根据推测,钫的电负性、电离能会比铯更高,这和碱金属从上到下电负性和电离能的变化趋势相反。此外,钫的原子半径可能会反常地低。
影片