電極極化
| 電極極化 |
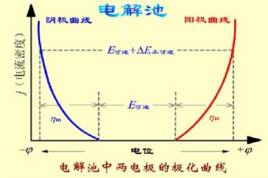 |
電極極化,在不可逆條件下,當有電流通過電極時,發生的是不可逆的電極反應,此時的電極電勢與可逆電極電勢會有所不同。電極在有電流通過時所表現的電極電勢與可逆電極電勢產生偏差的現象稱為電極極化。電極極化的特徵是:陰極電位比平衡電位更負(陰極極化),陽極電位比平衡電位更正(陽極極化)。
目錄
簡介
在可逆電池的情況下,整個電池處於電化學平衡狀態,兩個電極也分別處於平衡狀態,電極電位是由能斯特方程決定的,是平衡的電極電位。此時,通過電極的電流為零,即電極反應的速率為零。若要使一個不為零的電流通過電極,電極電位必須偏離平衡電極電位的值,這個現象就稱為電極的極化。
電極極化(electrode polarization) 電子導體與圍岩中溶液接觸時,會形成電偶層,產生電位跳躍,這個電位跳躍便稱為電子導體與溶液接觸時的電極電位。當有外電場作用時,相對平衡的電極電位數值將發生變化。通常把在-定電流密度作用下的電極電位與相對平衡的電極電位的差值,稱為電極極化。常見的有電化學極化、濃差極化等。由電極極化作用引起的電動勢叫做超電壓 。
評價
一個電極,在可逆情況下,電極上有一定的帶電程度,建立了相應的電極電勢jr。當有電流通過電極時,若電極一溶液界面處的電極反應進行得不夠快,導致電極帶電程度的改變,也可使電極電勢偏離jr。以電極(Pt)H2(g)|H為例,作為陰極發生還原作用時,由於H變成H2的速率不夠快,則有電流通過時到達陰極的電子不能被及時消耗掉,致使電極比可逆情況下帶有更多的負電,從而使電極電勢變得比jr低,這一較低的電勢能促使反應物活化,即加速H轉化成H2。當(Pt)H2(g)|H作為陽極發生氧化作用時,由於H2變成H的速率不夠快,電極上因有電流通過而缺電子的程度較可逆情況時更為嚴重,致使電極帶有更多的正電,從而電極電勢變得比jr高。這一較高的電勢有利於促進反應物活化,加速使H2變為H。將此推廣到所有電極,可得具有普遍意義的結論:當有電流通過時,由於電化學反應進行的遲緩性造成電極帶電程度與可逆情況時不同,從而導致電極電勢偏離jr的現象,稱為"活化極化"或"電化學極化"。電極發生活化極化時與發生濃差極化時一樣,陰極電勢總是變得比jr低,而陽極電勢總是變得比jr高。因活化極化而造成的電極電勢jI與jr之差的絕對值,稱為"活化過電勢"。活化過電勢的大小是電極活化極化的量度 。[1]