凝血障碍
凝血障碍
Coagulation disorders
凝血生理
正常人血液在血管中呈液态。当血管受损时,血液流出血管即凝成块状堵在破损处,使出血停止。止血机制的发生是由于凝血系的激活,即血浆中存在着的凝血因子发生了一系列的生化过程,最后导致纤维蛋白凝块的形成。同时,在血浆中还存在着一系列的抗凝血因子及纤维蛋白溶解系统,能有效地防止过度凝血,并使已形成的凝血块重新溶解,使血管腔再通。这几种机制在体内相互联系并制约,从而保证了机体的正常生理功能。因此,正常时虽然在血管内可有微量的纤维蛋白形成,但由于不断地溶解而维持了血液的流态。一旦平衡改变,就会产生各种病理现象。
凝血系
凝血系包括:①循环血液中的血浆凝血因子、钙离子、血小板。②异物表面,如血管壁受损时暴露出的内皮下胶质。③组织因子,由损伤的组织细胞所产生的脂蛋白所组成。凝血系的主要功能为执行止血功能,形成凝血酶,后者进一步加强血小板在止血过程中的功能并促使纤维蛋白原转变成纤维蛋白,形成纤维蛋白凝块
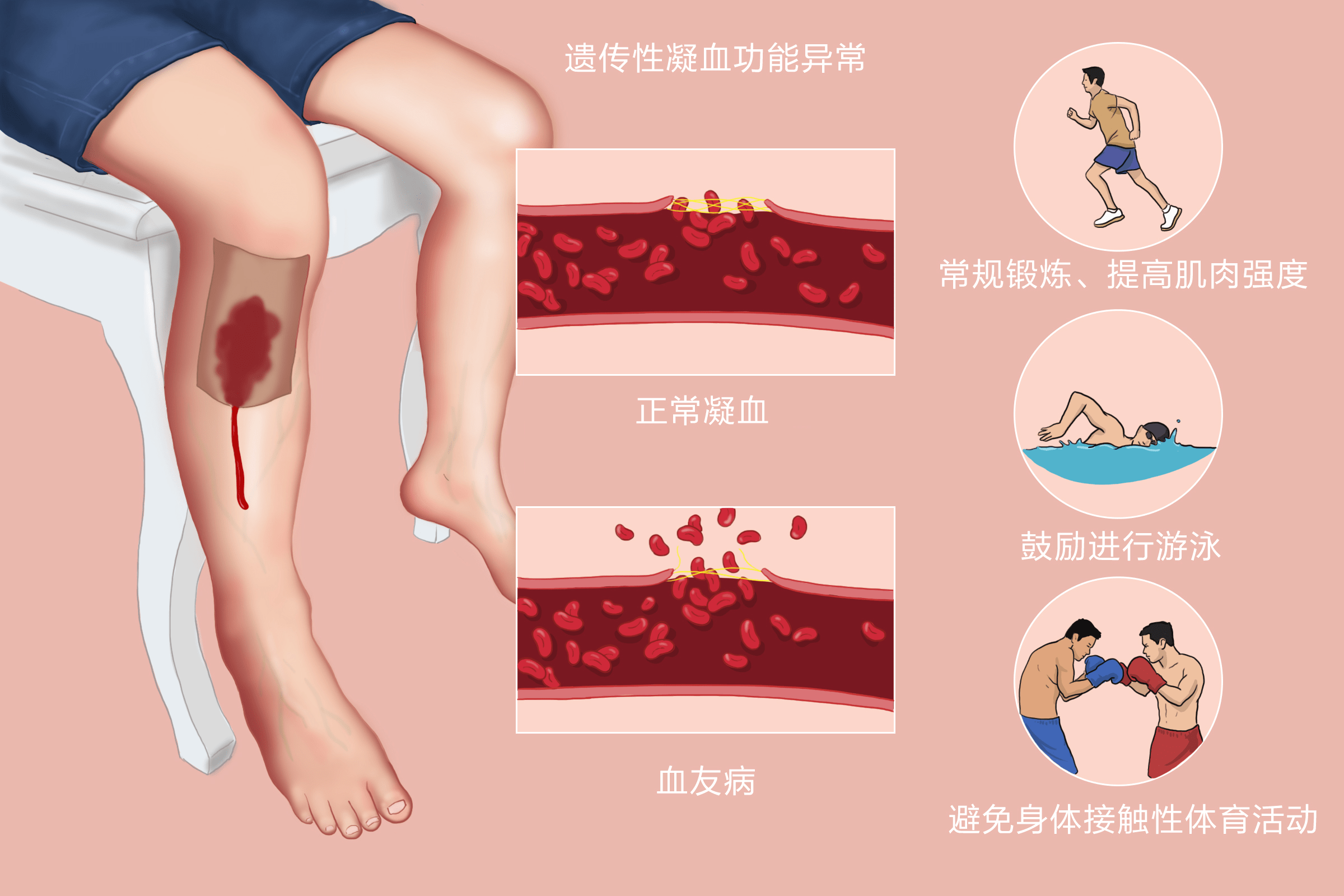
凝血因子有12个,除因子Ⅲ(组织因子)、因子Ⅳ(Ca2 )外都是蛋白质。血浆中的凝血因子平时都处于无活性状态,只有被活化后才具有凝血活性。一般认为凝血过程分为三个阶段即:凝血活酶形成阶段、凝血酶形成阶段和纤维蛋白形成阶段。凝血第一阶段即凝血活酶形成阶段,因其启动方式和激活因子Ⅹ的途径不同而又分为内源性途径(血液系统,参与的凝血因子都来自血液内部)和外源性途径(组织系统,有组织损伤后释出的组织因子参与)。活化的因子Ⅹ(Xa)和因子Ⅴ、血小板磷脂及Ca2 结合成的蛋白磷脂复合物即血浆凝血活酶(又名凝血酶原激活物),后者促使凝血酶原转变成凝血酶。一旦Xa形成,基本上就沿着一条共同途径(第二、三阶段)而使凝血酶原转变为凝血酶,纤维蛋白原转变为纤维蛋白,最终形成的不溶性纤维蛋白聚合体网罗各种血细胞而形成血凝块。为强调Xa形成对凝血第一阶段的重要性,可把因子Ⅹ的激活阶段作为凝血第一阶段的标识。
先天性或获得性凝血因子缺乏,血管壁受损,血小板功能不良等一种或一种以上的止血环节异常就可表现有出血症状。
抗凝系统
天然存在的生理性抗凝物质有抗凝血酶Ⅲ、蛋白C、肝素、α2巨球蛋白、α1抗胰蛋白酶、α2抗血浆素等。其先天性缺乏可以产生高血栓形成倾向。生理性抗凝物质过多很少见。病理性抗凝物质增多见于机体对某一凝血因子产生特异性抗体时(获得性),可导致凝血障碍。
纤溶系统
一些血浆因子,其功能是水解纤维蛋白或起溶解蛋白作用,能消化血管内纤维蛋白沉积物,或存在凝血块时的血管外纤维蛋白沉积物。此作用可有效地阻止过度的血栓形成,是机体重要的防御功能。纤溶酶原(血浆素原)是以酶原形式存在于血浆中的一种血浆因子,可被纤溶酶原激活物(血浆素原激活物)所激活,成为有活性的纤溶酶(血浆素)而起纤维蛋白溶解作用。纤溶酶是一种蛋白水解酶,可分解纤维蛋白原和纤维蛋白成为纤维蛋白降解产物 (FDP)。体内尚存在有抗纤溶酶(纤溶酶抑制物),能与纤溶酶或纤溶酶原相结合成复合物而迅速被清除,以控制纤溶活性,调节血浆中的纤溶酶水平。
血浆和机体许多组织(子宫、甲状腺、前列腺、肺、卵巢等),内皮细胞,尿液,体液(唾液、乳汁、泪液、精液)都存在有纤溶酶原激活物。当这些器官组织损伤时,大量组织激活剂释放入血流使纤溶酶原转变成纤溶酶。因此,某些病理情况下,纤溶系统被过度激活,这见于释出大量组织纤溶酶原激活物所产生的高纤溶酶状态,或是由于血浆中抗纤溶酶活力降低(如肝病)而导致广泛出血或血液凝固障碍,这称为原发性纤维蛋白溶解症。过量的纤溶酶形成,将使因子Ⅱ、Ⅴ、Ⅶ、Ⅸ、Ⅺ灭活以及纤维蛋白或止血栓很快被消化,引起临床出血现象。但是,由于病理性凝血酶的产生可导致弥漫性微血栓形成并继发性纤维蛋白溶解,则称为DIC。纤溶亢进所产生的大量纤维蛋白降解产物是一种很强的抗凝物质,干涉血块形成以及血小板的功能。
凝血障碍性疾病
分先天性和获得性两类。先天性凝血障碍性疾病:血友病甲、乙、丙;血管性假血友病(VWD,冯·维勒布兰德氏病);凝血因子缺乏性疾病(下列凝血因子均存在先天性缺乏症──Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅹ、Ⅺ、Ⅻ、ⅩⅢ、激肽释放酶原)。获得性凝血因子缺乏:维生素K缺乏;肝脏疾病;抗凝药物治疗;DIC;急性原发性纤溶;大量输注库存血;凝血因子抑制物质存在。
临床表现 血友病等先天性凝血因子缺乏所致的出血主要表现为创伤或手术后出血,皮肤粘膜出血,严重者肌肉关节出血,形成单个的深部血肿。获得性凝血因子缺乏,常是联合因子缺乏,出血以鼻衄,牙龈、皮肤、消化道、泌尿道出血为主,也可为肌肉血肿,关节或颅内出血少见。伴原发病的临床表现,且有血小板减少、血管壁功能障碍或纤溶亢进。
治疗 因治疗不同,凝血异常所致的出血性疾病必须早期诊断。获得性凝血障碍较多见,出血的原因有多种因素,须治疗原发病和进行支持性治疗。如减低血管脆性和通透性可用安络血、止血敏等;维生素K制剂用以治疗维生素K缺乏症;纤溶抑制剂用以治疗纤溶过盛引起的出血性疾病。先天性疾病以替代性治疗为主,输注新鲜血浆、库存血浆、全血或凝血因子浓制剂。
维生素K治疗 一组具有萘醌结构及不同侧链的化合物。按照其侧链的不同,分为K1、K2、K3等。K1、K2是维生素K的天然形式,脂溶性。K来自绿叶蔬菜、肉类、牛乳、植物油、蛋黄等天然食物中;K2由低位回肠及结肠内的细菌所合成。K3为一种合成的化合物,不具有侧链。虽然K3的二磷酸四钠盐为水溶性,易被吸收,但必须在肝脏内转化成维生素K2。因此在所有维生素K制品中,K1作用最迅速,本身无毒性,临床使用广泛,有侧链,并已能合成(见维生素K)。 生理功能 依赖维生素K的凝血因子有凝血酶原,因子Ⅶ、Ⅸ、Ⅹ,在内源与外源性凝血过程中均不可缺少。它们在肝脏内合成具有生理功能的凝血因子必须依赖维生素K的存在。
由肠道吸收的维生素K1通过血循环输送到肝脏,被肝细胞还原成氢醌,后者是位于内质网的羧化酶的辅酶。当因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的前驱物质(一种无功能的多肽)经肝细胞核蛋白体到内质网时,维生素K催化这些蛋白质氨基末端谷氨酸的γ羧化过程,形成一个可供钙离子结合的位点,使这些依赖维生素K的凝血因子具有生理功能。即能与钙离子相结合,继之结合到血小板磷脂表面,这是凝血酶形成所必须的二个过程。维生素K的体内代谢过程,可被双香豆素类所抑制。 适应症 用于三种常见的维生素K缺乏症:①继发于吸收或利用障碍所致的低凝血酶原血症。继发于脂肪的消化吸收障碍;肠道吸收功能减低;口服抗生素造成的肠内灭菌状态等。利用障碍包括严重肝病、肝功能衰竭。②新生儿低凝血酶原血症。③继发于双香豆素类药物的抗凝治疗。
纤溶抑制剂治疗 6-氨基己酸(EACA),是合成的氨基酸类化合物,具有抑制纤维蛋白溶解的作用。对羧基苄胺、止血环酸为其同类物。
药理作用 体外实验显示EACA有抑制血浆链激酶对纤溶酶原的活化作用,抑制纤溶酶及其他蛋白消化酶的作用,因此使纤维蛋白原对消化酶的作用不敏感。它能抑制实验性的体外抗原抗体反应,抑制组织胺的产生,局部注射能抑制人的结核菌素反应。
单剂量EACA口服后,在胃肠道中迅速完全地被吸收,2 小时血浆浓度达高峰。重复口服或静脉滴注可使血浆浓度得以维持。血浆浓度达130mg/ml时,将抑制血浆素原的活化作用。注入的EACA分布于血管内外间隙并迅速穿透入红细胞或其他人体细胞内。药物并不与血浆蛋白结合,在体内不发生代谢变化。注入或口服后40~60%经尿排出,在肾滤过并重吸收。
适应症
①治疗全身纤溶亢进及尿道局部纤溶过度引起的出血,急性危及生命的严重出血,有实验证实的纤溶活性增强。②某些血液系统疾病所致的出血。③用链激酶或尿激酶作溶栓治疗过量时,理论上可用EACA对抗,但使用方面的报道不多。④EACA对治疗上消化道出血、肺出血、月经过多、子宫切除术后的阴道出血均有效。
静脉滴注用于由纤溶亢进引起的急性出血症群。快速静脉推注可引起低血压、心动过缓、心律不齐等副作用,故应避免。但EACA的同类抑制剂如止血环酸(AMCA)、对羧基苄胺 (PAMBA)则可静脉推注。EACA口服剂量用于急性出血时,与静脉滴注量相仿。
副作用及反指征有恶心、呕吐、头晕、耳鸣、全身不适,结膜充血、鼻塞、皮疹等,但很轻微,停药即可消失。应用此药存在引起血栓形成的危险,因此对已有血管疾病的患者用此药应慎重。
反指征:心、肝、肾功能损害者应减量使用或慎用。由于此药有引起肾小球毛细血管血栓形成或形成不能被溶解的凝血块的危险,故由上尿路出血所致血尿的患者禁用。
所属分类
参考文献
- ↑ 凝血障碍 概述-症状库复禾健康
- ↑ 凝血障碍是什么病健康之路