蛋白激酶A查看源代码讨论查看历史
 |
蛋白激酶A是全国科学技术名词审定委员会审定、公布的科技类名词。
关于汉字的起源[1],中国古代文献上有种种说法,如“结绳”、“八卦”、“图画”、“书契”等,古书上还普遍记载有黄帝史官仓颉造字的传说。现代学者认为,成系统的文字工具不可能完全由一个人创造出来,仓颉[2]如果确有其人,应该是文字整理者或颁布者。最早刻划符号距今8000多年。
名词解释
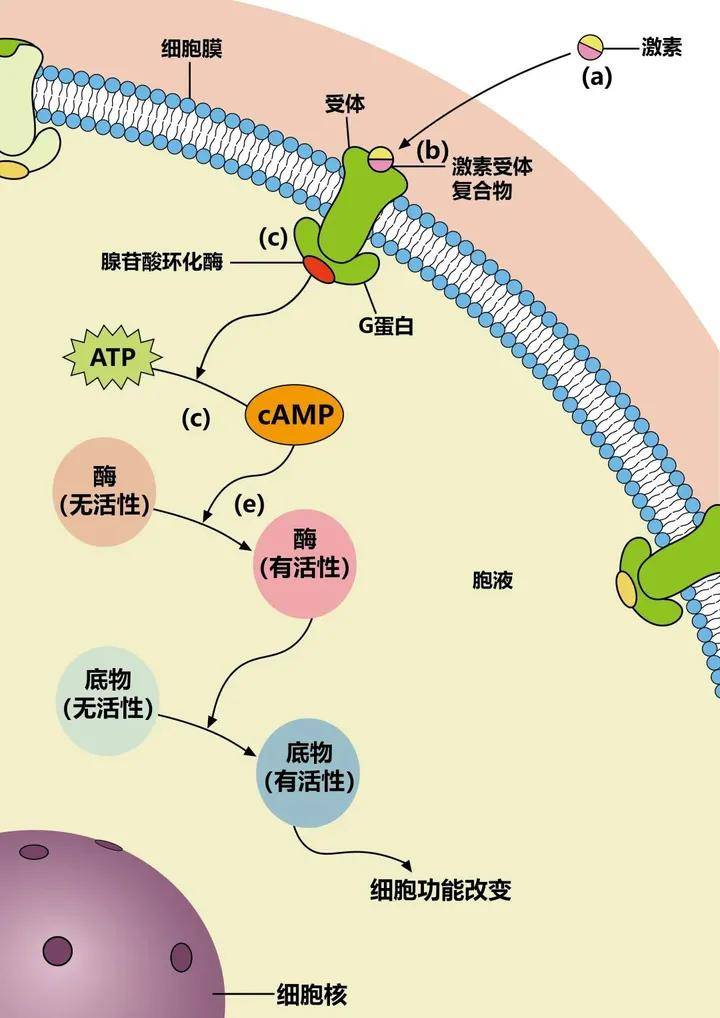
蛋白激酶A(protein kinase A,PKA)又称依赖于cAMP的蛋白激酶A(cyclic-AMP dependent protein kinase A),是一种结构最简单、生化特性最清楚的蛋白激酶。
PKA全酶分子是由四个亚基组成的四聚体,其中两个是调节亚基(regulatory subunit,简称R亚基),另两个是催化亚基(catalytic subunit,简称C亚基)。R亚基的相对分子质量为49~55kDa,C亚基的相对分子质量为40kDa,总相对分子质量约为180kDa;全酶没有活性。在大多数哺乳类细胞中,至少有两类蛋白激酶A,一类存在于胞质溶胶,另一类结合在质膜、核膜和微管上。
激酶介绍
激酶是激发底物磷酸化的酶,所以蛋白激酶A的功能是将ATP上的磷酸基团转移到特定蛋白质的丝氨酸或苏氨酸残基上进行磷酸化,被蛋白激酶磷酸化了的蛋白质可以调节靶蛋白的活性。
一般认为,真核细胞内几乎所有的cAMP的作用都是通过活化PKA,从而使其底物蛋白发生磷酸化而实现的。
蛋白激酶A(Protein Kinase A,PKA):由两个催化亚基和两个调节亚基组成,在没有cAMP时,以钝化复合体形式存在。cAMP与调节亚基结合,改变调节亚基构象,使调节亚基和催化亚基解离,释放出催化亚基。活化的蛋白激酶A催化亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化,于是改变这些蛋白的活性,进一步影响到相关基因的表达。
蛋白激酶A在细胞中具有多种功能,包括调节糖原、糖和脂质的代谢。
功能背景
蛋白激酶 A,更准确地说是腺苷 3',5'-单磷酸(环磷腺苷)依赖的蛋白激酶,缩写为 PKA,是由化学家埃德蒙·H·费舍尔和埃德温·G·克雷布斯在 1968 年发现的。他们因研究磷酸化和去磷酸化及其与 PKA 活性的关系而于 1992 年获得诺贝尔生理学或医学奖。
PKA 是最广泛研究的蛋白激酶之一,部分原因是它的独特性;在构成人类激酶组的 540 个不同蛋白激酶基因中,只有另一个蛋白激酶,酪蛋白激酶 2,被知道以生理四聚体复合物存在,这意味着它由四个亚基组成。
在斯坦·麦克奈特博士和其他人确定了四个可能的催化亚基基因和四个调节亚基基因后,人们意识到哺乳动物 PKA 亚基的多样性。1991 年,苏珊·泰勒和同事们对 PKA Cα 亚基进行了结晶,首次揭示了蛋白激酶核心的双叶结构,为基因组中所有其他蛋白激酶(激酶组)提供了蓝图。
结构
当不活跃时,PKA 全酶以四聚体形式存在,由两个调节亚基和两个催化亚基组成。催化亚基包含活性位点,一系列在蛋白激酶中发现的、能结合和水解 ATP 的典型残基,以及一个与调节亚基结合的域。调节亚基有结合环磷腺苷的域、与催化亚基相互作用的域,以及一个自抑制域。调节亚基有两种主要形式;RI 和 RII。
哺乳动物细胞至少有两种类型的 PKAs:类型 I 主要在细胞质中,而类型 II 通过其调节亚基和特殊的锚定蛋白(在锚定部分中描述)绑定到质膜、核膜、线粒体外膜和微管上。在这两种类型中,一旦催化亚基被释放并活跃,它们可以迁移到核内(在那里它们可以磷酸化转录调节蛋白),而调节亚基则留在细胞质中。
以下人类基因编码 PKA 亚基:
催化亚基 - PRKACA、PRKACB、PRKACG
调节亚基类型 I - PRKAR1A、PRKAR1B
调节亚基类型 II - PRKAR2A、PRKAR2B
参考文献
- ↑ 中国“汉字”从何而来?每个汉字,都是仓颉造出来的吗?,搜狐,2022-10-01
- ↑ 造字的仓颉,为何叫“仓颉”?甲骨文揭开了颠覆性的一幕,搜狐,2022-09-12