蛋白激酶A檢視原始碼討論檢視歷史
 |
蛋白激酶A是全國科學技術名詞審定委員會審定、公布的科技類名詞。
關於漢字的起源[1],中國古代文獻上有種種說法,如「結繩」、「八卦」、「圖畫」、「書契」等,古書上還普遍記載有黃帝史官倉頡造字的傳說。現代學者認為,成系統的文字工具不可能完全由一個人創造出來,倉頡[2]如果確有其人,應該是文字整理者或頒布者。最早刻劃符號距今8000多年。
名詞解釋
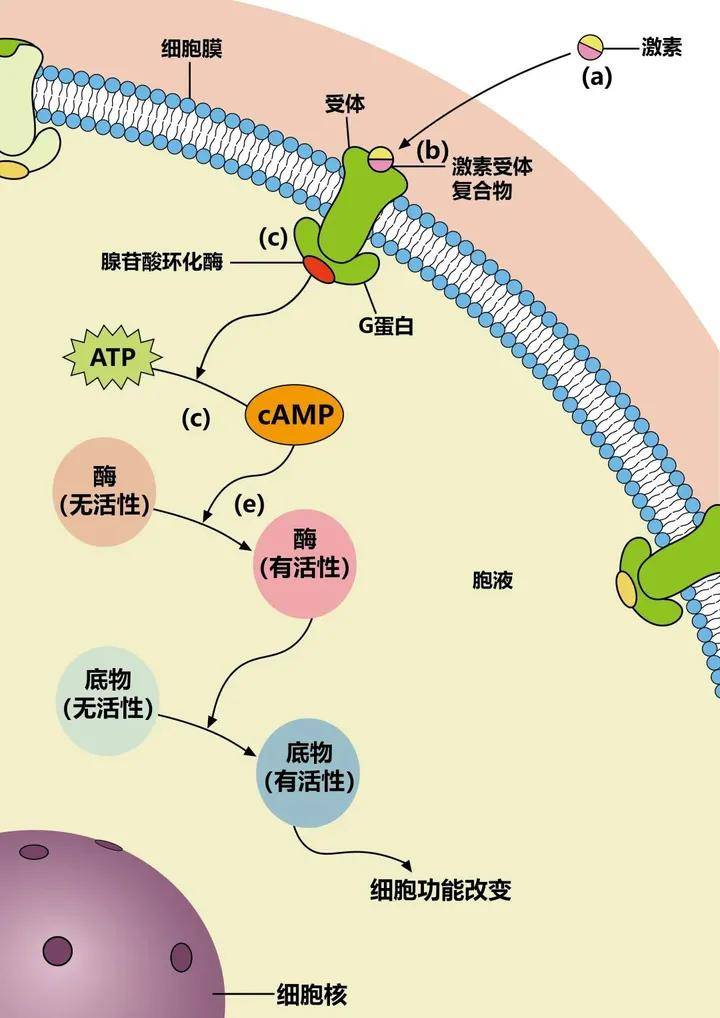
蛋白激酶A(protein kinase A,PKA)又稱依賴於cAMP的蛋白激酶A(cyclic-AMP dependent protein kinase A),是一種結構最簡單、生化特性最清楚的蛋白激酶。
PKA全酶分子是由四個亞基組成的四聚體,其中兩個是調節亞基(regulatory subunit,簡稱R亞基),另兩個是催化亞基(catalytic subunit,簡稱C亞基)。R亞基的相對分子質量為49~55kDa,C亞基的相對分子質量為40kDa,總相對分子質量約為180kDa;全酶沒有活性。在大多數哺乳類細胞中,至少有兩類蛋白激酶A,一類存在於胞質溶膠,另一類結合在質膜、核膜和微管上。
激酶介紹
激酶是激發底物磷酸化的酶,所以蛋白激酶A的功能是將ATP上的磷酸基團轉移到特定蛋白質的絲氨酸或蘇氨酸殘基上進行磷酸化,被蛋白激酶磷酸化了的蛋白質可以調節靶蛋白的活性。
一般認為,真核細胞內幾乎所有的cAMP的作用都是通過活化PKA,從而使其底物蛋白發生磷酸化而實現的。
蛋白激酶A(Protein Kinase A,PKA):由兩個催化亞基和兩個調節亞基組成,在沒有cAMP時,以鈍化複合體形式存在。cAMP與調節亞基結合,改變調節亞基構象,使調節亞基和催化亞基解離,釋放出催化亞基。活化的蛋白激酶A催化亞基可使細胞內某些蛋白的絲氨酸或蘇氨酸殘基磷酸化,於是改變這些蛋白的活性,進一步影響到相關基因的表達。
蛋白激酶A在細胞中具有多種功能,包括調節糖原、糖和脂質的代謝。
功能背景
蛋白激酶 A,更準確地說是腺苷 3',5'-單磷酸(環磷腺苷)依賴的蛋白激酶,縮寫為 PKA,是由化學家埃德蒙·H·費舍爾和埃德溫·G·克雷布斯在 1968 年發現的。他們因研究磷酸化和去磷酸化及其與 PKA 活性的關係而於 1992 年獲得諾貝爾生理學或醫學獎。
PKA 是最廣泛研究的蛋白激酶之一,部分原因是它的獨特性;在構成人類激酶組的 540 個不同蛋白激酶基因中,只有另一個蛋白激酶,酪蛋白激酶 2,被知道以生理四聚體複合物存在,這意味着它由四個亞基組成。
在斯坦·麥克奈特博士和其他人確定了四個可能的催化亞基基因和四個調節亞基基因後,人們意識到哺乳動物 PKA 亞基的多樣性。1991 年,蘇珊·泰勒和同事們對 PKA Cα 亞基進行了結晶,首次揭示了蛋白激酶核心的雙葉結構,為基因組中所有其他蛋白激酶(激酶組)提供了藍圖。
結構
當不活躍時,PKA 全酶以四聚體形式存在,由兩個調節亞基和兩個催化亞基組成。催化亞基包含活性位點,一系列在蛋白激酶中發現的、能結合和水解 ATP 的典型殘基,以及一個與調節亞基結合的域。調節亞基有結合環磷腺苷的域、與催化亞基相互作用的域,以及一個自抑制域。調節亞基有兩種主要形式;RI 和 RII。
哺乳動物細胞至少有兩種類型的 PKAs:類型 I 主要在細胞質中,而類型 II 通過其調節亞基和特殊的錨定蛋白(在錨定部分中描述)綁定到質膜、核膜、線粒體外膜和微管上。在這兩種類型中,一旦催化亞基被釋放並活躍,它們可以遷移到核內(在那裡它們可以磷酸化轉錄調節蛋白),而調節亞基則留在細胞質中。
以下人類基因編碼 PKA 亞基:
催化亞基 - PRKACA、PRKACB、PRKACG
調節亞基類型 I - PRKAR1A、PRKAR1B
調節亞基類型 II - PRKAR2A、PRKAR2B
參考文獻
- ↑ 中國「漢字」從何而來?每個漢字,都是倉頡造出來的嗎?,搜狐,2022-10-01
- ↑ 造字的倉頡,為何叫「倉頡」?甲骨文揭開了顛覆性的一幕,搜狐,2022-09-12