吸氧腐蝕檢視原始碼討論檢視歷史
| 吸氧腐蝕 |
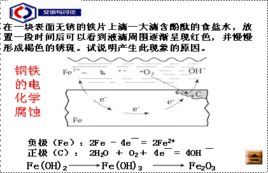 |
吸氧腐蝕是金屬在空氣中最普遍發生的一種腐蝕方式,在酸性、鹼性和中性條件下都能發生作用。發生機理是由於金屬表面有水分,後通過原電池原理髮生作用,使得金屬(如:鋼鐵)被空氣中的氧氣腐蝕,產生生鏽,由於此過程中需要消耗氧氣,故名為:吸氧腐蝕或者耗氧腐蝕。
簡介
例如,鋼鐵在接近中性的潮濕的空氣中的腐蝕就屬於吸氧腐蝕。
鋼鐵等金屬的電化腐蝕主要是吸氧腐蝕.
吸氧腐蝕的必要條件
以氧的還原反應為陰極過程的腐蝕,稱為氧化還原腐蝕或吸氧腐
蝕。發生吸氧腐蝕的必要條件是:金屬的電位比氧化還原反應的電位低。
吸氧腐蝕的陰極去極化劑是溶液中溶解的氧。隨着腐蝕的進行,氧不斷消耗,只有來自空氣中的氧進行補充。因此,氧從空氣中進入溶液並遷移到陰極表面發生還原反應,這一過程包括一系列步驟。
(1) 氧穿過空氣/溶液界面進入溶液;
(2) 在溶液對流作用下,氧遷移到陰極表面附近;
(3) 在擴散層範圍內,氧在濃度梯度作用下擴散到陰極表面;
(4) 在陰極表面氧分子發生還原反應,也叫氧的離子化反應。
評價
隨着鹽濃度的增加,溶液導電性增加,腐蝕速度增加;同時,隨着鹽量增加,氧在溶液中的所謂溶解度降低,從而降低腐蝕速度。鹽量的這種雙重作用導致金屬腐蝕速度在某個鹽濃度時出現極大值在鹽濃度很低時,氧的溶解度比較大,供氧充分,此時隨着鹽濃度增加,由於電導率增加,吸氧腐蝕速度增加。當鹽濃度進一步增加,會使溶解度顯著降低,從而吸氧腐蝕速度也降低。
溶液攪拌和流速的影響
在氧濃度一定的條件按下,極限擴散電流密度與擴散層厚度成反比,溶液流速越大,擴散層厚度越小,氧的極限電流密度也就越大,腐蝕速度越大。
析氫腐蝕與吸氧腐蝕的比較[1]