MTT法檢視原始碼討論檢視歷史
| MTT法 |
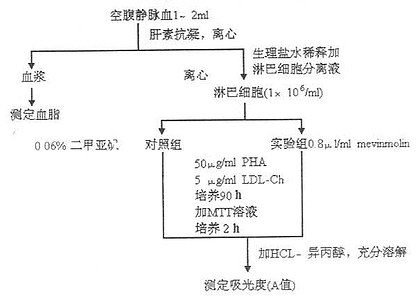 |
MTT法又稱MTT比色法,是一種檢測細胞存活和生長的方法。其檢測原理為活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT還原為水不溶性的藍紫色結晶甲瓚(Formazan)並沉積在細胞中,而死細胞無此功能。二甲基亞碸(DMSO)能溶解細胞中的甲瓚,用酶聯免疫檢測儀在540 或720nm波長處測定其光吸收值,可間接反映活細胞數量。在一定細胞數範圍內,MTT結晶形成的量與細胞數成正比。該方法已廣泛用於一些生物活性因子的活性檢測、大規模的抗腫瘤藥物篩選、細胞毒性試驗以及腫瘤放射敏感性測定等。它的特點是靈敏度高、經濟。
簡介
MTT法只能用來檢測細胞相對數和相對活力,但不能測定細胞絕對數。在用酶標儀檢測結果的時候,為了保證實驗結果的線性,MTT 吸光度最好在0-0.7 範圍內。
MTT一般最好現用現配,過濾後4ºC避光保存兩周內有效,或配製成5mg/ml保存在-20度長期保存,避免反覆凍融,最好小劑量分裝,用避光袋或是黑紙、錫箔紙包住避光以免分解。我一般都把MTT粉分裝在EP管里,用的時候現配,直接往培養板中加,沒必要一下子配那麼多,尤其當MTT變為灰綠色時就絕對不能再用了。
MTT有致癌性,用的時候小心,有條件最好帶那種透明的簿膜手套.配成的MTT需要無菌,MTT對菌很敏感;往96孔板加時不避光也沒有關係,畢竟時間較短,或者你不放心的時候可以把操作台上的照明燈關掉.
配製MTT時用用PBS溶解,也有人用生理鹽水配,60℃水浴助溶。
PBS配方:
Nacl 8g
Kcl 0.2g
Na2HPO4 1.44g
KH2PO4 0.24g
調pH 7.4
定容1L
評價
貼壁細胞
1、收集對數期細胞,調整細胞懸液濃度,每孔加入100ul,鋪板使待測細胞調密度至1000-10000孔,(邊緣孔用無菌PBS填充)。
2.、5%CO2,37℃孵育,至細胞單層鋪滿孔底(96孔平底板),加入濃度梯度的藥物,原則上,細胞貼壁後即可加藥,或兩小時,或半天時間,但我們常在前一天下午鋪板,次日上午加藥.一般5-7個梯度,每孔100ul,設3-5個復孔.建議設5個,否則難以反應真實情況
3.、5%CO2,37℃孵育16-48小時,倒置顯微鏡下觀察。
4、每孔加入20ulMTT溶液(5mg/ml,即0.5%MTT),繼續培養4h。若藥物與MTT能夠反應,可先離心後棄去培養液,小心用PBS沖2-3遍後,再加入含MTT的培養液。
5、終止培養,小心吸去孔內培養液。
6、每孔加入150ul二甲基亞碸,置搖床上低速振盪10min,使結晶物充分溶解。在酶聯免疫檢測儀OD490nm處測量各孔的吸光值。
7、同時設置調零孔(培養基、MTT、二甲基亞碸),對照孔(細胞、相同濃度的藥物溶解介質、培養液、MTT、二甲基亞碸)
懸浮細胞
1、收集對數期細胞,調節細胞懸液濃度1×106/ml,按次序將①補足的1640(無血清)培養基40ul ;②加Actinomycin D(有毒性)10ul用培養液稀釋 lg/ml,需預試尋找最佳稀釋度,1:10-1:20);③需檢測物10ul;④細胞懸液50ul(即5×104cell/孔),共100ul加入到96孔板(邊緣孔用無菌水填充)。每板設對照(加100(儲存液100 1640)。
2、置37℃,5%CO2孵育16-48小時,倒置顯微鏡下觀察。
3、每孔加入10 ul MTT溶液(5 mg/ml,即0.5%MTT),繼續培養4 h。(懸浮細胞推薦使用WST-1,培養4 h後可跳過步驟4),直接酶聯免疫檢測儀OD570nm(630nm校準)測量各孔的吸光值)
4、離心(1000轉x10min),小心吸掉上清,每孔加入100 ul二甲基亞碸,置搖床上低速振盪10 min,使結晶物充分溶解。在酶聯免疫檢測儀OD570nm(630nm校準)測量各孔的吸光值。
5、同時設置調零孔(培養基、MTT、二甲基亞碸),對照孔(細胞、相同濃度的藥物溶解介質、培養液、MTT、二甲基亞碸),每組設定3復孔。